 |
ALÓTROPOS DO CARBONO
Entre os elementos químicos, o carbono revela-se um dos mais eclécticos, constituindo-se como a "espinha dorsal" de moléculas como o ADN, as proteínas, o petróleo, todas de importância vital para a vida. A particularidade do carbono advém da capacidade de estabelecer ligações estáveis consigo próprio, ao contrário da maioria dos parceiros que se ligam a elementos químicos diferentes.
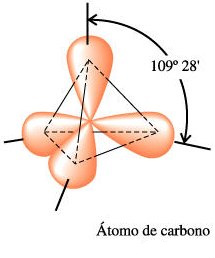
Quando átomos de carbono se ligam entre si, podem originar compostos com estruturas e propriedades completamente distintas, como acontece com o caso da grafite e do diamante. Na grafite verifica-se uma sobreposição de "folhas" de grafeno, estruturas planas de carbono com um átomo de espessura. Nestas folhas, constata-se um arranjo periódico de átomos, onde cada um se liga a três adjacentes. No diamante, por seu turno, cada átomo está ligado a quatro vizinhos dispostos simetricamente no espaço como se estivessem nos vértices de um tetaedro. É interessante notar que embora sejam formados por arranjos de ligações covalentes entre átomos de carbono, estes dois materiais possuem características bastante distintas. A primeira é um material opaco, extremamente mole, com pequeno brilho metálico, óptimo condutor de electricidade, o segundo é transparente, de alta dureza e isolante.
FULERENOS
Há cerca de duas décadas atrás, a grafite e o diamante eram os únicos materiais conhecidos, constituídos exclusivamente por átomos de carbono. A partir de 1960, os estudos envolvendo materiais à base de carbono tiveram um grande impulso. Tal ficou a dever-se à produção de diamante sintético sob condições excepcionais de temperatura e pressão. Esta descoberta gerou um grande impacto na ciência do carbono, e teve como consequência imediata a síntese da primeira grafite pirolítica altamente orientada (highly oriented pyrolytic graphite).
Em 1969, uma nova forma alotrópica de carbono, que ficou conhecida como "carbono branco", foi produzida durante a sublimação da grafite pirolítica a baixa pressão. A descoberta de uma nova forma de um elemento puro é uma ocorrência assz rara, especialmente para um elemento comum como o carbono. Estas sequências de descobertas incentivaram os pesquizadores para o estudo deste material.
Como resultado, em 1985 surege a descoberta da possibilidade da organização dos átomos de carbono no espaço em forma de bolas, os fulerenos.
Esta descoberta, publicada na revista Nature de 14 de Novembro de 1985 (vol 318, p.162), ficou a dever-se ao inglês Harold W. Kroto (Universidade de Sussex, em Brighton, Inglaterra) e aos americanos Robert F. Curl e Richard E. Smalley (Universidade Rice, em Houston, Texas, EUA), que fruto de experiências no sentido de compreender os mecanismos de formação de longas cadeias de carbono no espaço interestelar, anunciaram mais uma forma alotrópica de carbono, sendo que esta era a primeira molecular, o Hentriacontaciclo [29. 29 .0 .02,14 .03,12 .04,59 .05,10 .06,58 .07,55 .08,53 .09,21 .011,20 .013,18 .015,30 .016,28 .017,25. 019,24 .022,52 .023,50 .026,49 .027,47 .029,45 .032,44 .033,60 .034,57 .035,43 .036,56 .034,41 .038,54. 039,51 .040,48 .042,46] hexaconta-1, 3, 5(10), 6, 8, 11, 13(18), 14, 16, 19, 21, 23, 25, 27, 29(45), 30, 32(44), 33, 35(43), 36, 38(54), 39(51), 40(48), 41, 46, 49, 52, 55, 57, 59 - triacontaene, mais frequentemente designado por buckminsterfulereno (C60), fulereno ou buckyball, devido à sua forma, esfera oca constituída por 20 hexágonos e 12 pentágonos, se assemelhar às cúpulas geodésicas idealizadas pelo arquitecto Richard Buckminster Fuller. Preparado
através do método de sublimação a laser, o material predominante formado consistia de espécies formadas por moléculas que contêm 60 átomos de carbono.
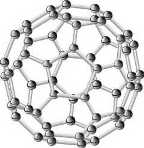
Os fulerenos são sólidos de cor preta. O C60 absorve a luz visível pelo que a solução de C60 age como limitador óptico (material que limita a intensidade da luz a um valor máximo, convertendo a luz em excesso em calor). Esta propriedade abre excelentes possibilidades de utilizar este material associado a outro como filtro.
A buckyball é potencialmente perigosa na presença do ar ou da luz, uma vez que a molécula excitada tem a capacidade de transferir esta energia "extra" para o oxigénio atmosférico, dando origem a oxigénio muito excitado, muito tóxico para os tecidos vivos. Esta singularidade está a ser investigada com grande entusiasmo na área da saúde.
Combinados com metais alcalinos, os fulerenos ganham propriedades de super condutores, revelando uma temperatura de transição para o estado de supercondutividade a cerca de 17K (-256ºC).
A primeira vez que se conseguiu obter diamante à temperatura ambiente foi sujeitando o C60 a pressão da ordem das 250 mil atmosferas, concluindo-se que é mais fácil o processo a partir do C60 do que da grafite (pressões superiores a 100 000 atm e temperaturas superiores a 2800ºC).
As pesquisas científicas à volta dos fulerenos cresceram significativamente após a sua descoberta, principalmente no que diz respeito ao desenvolvimento de novos métodos de síntese e estudos de propriedades. Isto originou um maior interesse no estudo de estruturas baseadas em carbono puro, levando à descoberta de uma série de novas formas, incluindo os chamados "bucky-onions" (formados por camadas esféricas e concêntricas de grafeno) e os nanotubos de carbono.
Ana Rita Maltez
Página anterior /
Próxima página
|
|